查看更多 +

品牌列表
Brand list
-
仪器设备

-
试剂耗材

- Biolife Solutions
- Sexton 人血小板裂解液
- Nordmark 胶原酶
- Polysciences 化学品
- Biogenes宿主蛋白残留检测试剂盒
- Sirion Biotech LentiBOOST LV转导增强剂
- NIBSC 标准品
- QKine 细胞因子
- InSphero 3D细胞培养耗材
- Lab Bioreagents 免疫学检测缓冲液
- Ligand PeliCRM197 白喉毒素突变体
- GA international 实验室标签解决方案
- Cellagen Technology 小分子抑制剂
- Ethos(Exocell) 肾病学检测试剂盒
- Akron CGT cGMP辅助材料
- Visual Protein免疫印迹相关试剂
- Quan Lab 泉品
-
细胞

-
AlibioBuy代理品牌

- Abbexa
- Abnova
- Advion Interchim scientific
- Ajinomoto
- ALPCO
- amsbio
- AssayGenie
- Biorelevant
- Cell Biologics
- CellMosaic
- Chondrex
- Enamine
- Focus Biomolecules
- GeneProof
- GroPep
- highQu
- Human Cell Design 胰岛B细胞
- Immudex
- Innovative Research of America
- InvivoGen
- KAMIYA
- Krishgen BioSystems
- Mercodia
- Moss
- MyBioSource
- Prosci
- SouthernBiotech
- teknova
- ViraTree
- Abbexa


Transporter 5 Transfection Reagent
-
品牌:polysciences
-
品名:Transporter 5 Transfection Reagent
-
型号:26008-50
-
规格:50ml
-
目录价:18131


- 产品详情
- 使用方法
- 技术专栏
- 相关应用
- 相关视频
- 资料下载
产品简介
Transporter 5转染试剂是一种非GMP等级的即用型线性聚乙烯亚胺(PEI转染试剂)溶液,由PEI MAX配置而成,采用0.1um PES无菌过滤器,完全消除支原体污染风险。Transporter 5将DNA缩聚成带正电荷的复合物,这些复合物很容易通过内吞作用进入细胞,并且Transporter 5-DNA 复合物能很好地抵御溶酶体的降解作用,有效提高转染效率。适用于工艺开发、临床前和早期临床研究,可无缝过渡到MAXgene GMP用于商业化生产。
Transporter 5转染试剂能效率更高地将DNA转染入HEK-293、CHO、COS、HELA、昆虫(SF9、SF21) 等真核细胞系,可作用于大到135,000个核苷酸的质粒,所以较大的质粒也可以成功地转染。
Transporter 5可节省试剂准备时间,加快项目进度。经过严格的性能检测,确保品质,在新药研发过程中是一款快速、重复性好、可用于批量产的转染试剂。
产品特点
l非GMP,研究级PEI转染试剂溶液
l高转染效率
l无缝过渡到MAXgene GMP
l易放大,可预测产量
l用于工艺开发,临床前和早期临床研究
转染示意图

含血清培养的贴壁细胞转染流程
1. 准备工作
• 转染前 18~24 小时细胞铺板。
• 在培养基中加入合适数量的细胞,以确保在转染前形成 60~80%汇合度的单细胞层,此为最理想的细胞转染密度。
各规格培养容器中贴壁细胞铺板密度参考表
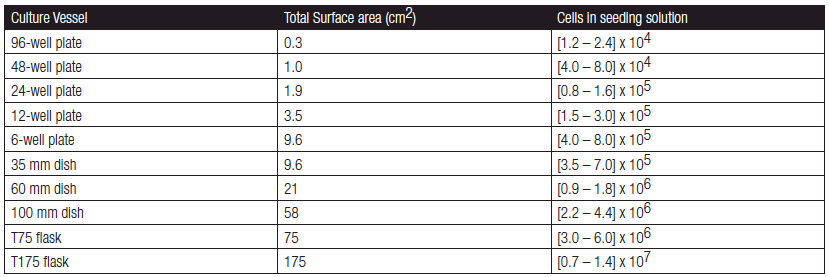
2. 转染步骤(以 6 孔板单孔举例)
• 转染前 1~2 小时,将需要转染的孔中的培养基替换成 3 mL 新鲜的含有2%低血清或无血清的培养基。(高浓度血清抑制 Transporter 5 的性能,大多数情况下,较低的血清含量(≤ 5%)或无血清将获得较高的转染效率)。
• 准备Transporter 5-DNA 转染混合物(以下操作顺序尤为关键)。
1) 在含有300uL(3mL的10%)稀释液的聚丙烯 EP 管中加入 2ug质粒 DNA;
2) 轻轻地混匀/振荡溶液;
3) 在 DNA 溶液中加入 2~8 uL Transporter 5 转染试剂(Transporter 5-DNA 的比例建议在 1~4:1 之间优化,首次推荐使用 2:1 或 3:1);
4) 涡旋振荡 5 秒钟;
5) 将管子静置于超净工作台 10~15 分钟,使 Transporter 5-DNA 复合物形成(建议共孵育时间不超过 20 分钟);
6) 用移液器轻轻上下吹打混合液 3 次
• 边晃动细胞培养板,边将 Transporter 5-DNA 混合液加入更换了培养基的转染孔中,确保 Transporter 5-DNA 复合物均匀分布,防止局部浓度过高。
3. 孵育培养
• 将细胞培养板放入培养箱培养 18~24小时后,更换含有血清的正常培养基;
• 通常,在转染后 36-48 小时可检测到重组蛋白表达或包装的病毒颗粒,转染后 72-96 小时可观察到最大产量。
经过驯化的无血清培养悬浮细胞转染流程
1.准备工作
转染前 2~3 小时,种植细胞密度为 1X106 /mL 于培养容器中。
2. 转染步骤(以 250 mL 摇瓶为例,转染前种植细胞总体积为 25 mL,最终总培养体积为 50 mL)
准备 Transporter 5-DNA 转染混合物(以下操作顺序尤为关键)。
1)在含有 2.5 mL(25mL 的 10%)稀释液的聚丙烯 EP 管中加入 50ug 质粒 DNA(质粒用量建议在 1~2ug/106 细胞之间优化,此处使用 2ug/106 细胞)
2) 轻轻地混匀/振荡溶液
3) 在 DNA 溶液中加入 50~200uL Transporter 5 转染试剂(Transporter 5/DNA 的比例建议在 1~4:1 之间优化,首次推荐使用 2:1 或 3:1)
4) 涡旋振荡 5 秒钟
5) 将管子静置于超净工作台 10~15 分钟,使 Transporter 5-DNA 复合物形成(建议共孵育时间不超过 20 分钟)
6) 用移液器轻轻上下吹打混合液 3 次
注:边晃动摇瓶,边将 Transporter 5-DNA 混合液加入更换了培养基的转染孔中,确保Transporter 5-DNA 复合物均匀分布,防止局部浓度过高。
3. 孵育培养
将细胞培养瓶放入培养箱,摇瓶培养 2~3 小时后,加入 25 mL 新鲜培养基,继续培养。
通常,在转染后 36-48 小时可检测到重组蛋白表达或包装的病毒颗粒。转染后 72-96 小时可观察到最大产量。













 在线咨询
在线咨询 资料下载
资料下载















